15 CÂU HỎI
Số oxi hóa của một nguyên tử trong phân tử được định nghĩa là
A. điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn;
B. hóa trị của nguyên tử nguyên tố đó;
C. điện tích thực của nguyên tử nguyên tố đó;
D. độ âm điện của nguyên tử nguyên tố đó.
Cho nguyên tố X có số oxi hóa có giá trị là -2. Cách biểu diễn đúng là
A.  ;
;
B.  ;
;
C. 
D.  .
.
Số oxi hóa của các nguyên tử trong H2, Fe2+, Cl− lần lượt là
A. 0; −2; +1;
B. +2; −2; +1;
C. 0; +2; −1;
D. +1; +2; −1.
Phát biểu nào sau đây sai khi nói về số oxi hóa trong hợp chất?
A. Số oxi hóa của H là +1 (trừ một số hydride kim loại NaH, CaH2, …);
B. Số oxi hóa của O luôn là –2;
C. Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, …) luôn là +1, của kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, …) luôn là +2;
D. Số oxi hóa của Al luôn là +3, của F luôn là –1.
Số oxi hóa của Mn trong các phân tử MnO2, KMnO4, K2MnO4 lần lượt là
A. +2, +4, +3;
B. −4, +7, +6;
C. +4, +7, +6;
D. +2, +5, +6.
Số oxi hóa của nguyên tử N trong các ion NH4+, NO3−, NO2− lần lượt là
A. −3, +5, +3
B. −3, +3, + 5
C. +5, −2, +3
D. +5, +3, +2
Cho phân tử CH4 công thức cấu tạo dưới đây. Số oxi hóa của C là
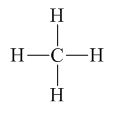
A. −4;
B. −2;
C. +4;
D. +2.
Phát biểu sai là
A. Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử;
B. Phản ứng oxi hóa – khử có thể chỉ có quá trình oxi hóa hoặc quá trình khử;
C. Quá trình oxi hóa (sự oxi hóa) là quá trình nhường electron;
D. Quá trình khử (sự khử) là quá trình nhận electron.
Chất khử là chất
A. nhận electron, có số oxi hóa tăng, bị oxi hóa
B. nhận electron, có số oxi hóa giảm, bị khử
C. nhường electron, có số oxi hóa tăng, bị oxi hóa
D. nhường electron, có số oxi hóa giảm, bị khử
Phản ứng nào dưới đây là phản ứng oxi hóa – khử?
A. SO3 + H2O ⟶H2SO4
B. CaCO3 CaO + CO2 ↑
CaO + CO2 ↑
C. H2SO4 + Ba(OH)2 ⟶ BaSO4 ↓ + 2H2O
D. Mg + 2HCl ⟶ MgCl2 + H2 ↑
Cho phản ứng: Fe + CuSO4 ⟶ Cu + FeSO4.
Khẳng định đúng là
A. Chất khử là Cu2+, chất oxi hóa là Fe;
B. Chất khử là Fe, chất oxi hóa là Cu2+;
C. Chất khử là Cu, chất oxi hóa là Fe2+;
D. Chất khử là Fe2+, chất oxi hóa là Cu.
Cho phản ứng: 3Cu + 8H+ + 2NO3−⟶3Cu2+ + 2NO + 4H2O
Quá trình khử là
A.  + 3e ⟶
+ 3e ⟶ ;
;
B.  + 2e ⟶
+ 2e ⟶ ;
;
C.  ⟶
⟶ + 3e;
+ 3e;
D.  ⟶
⟶ + 2e.
+ 2e.
Cho phản ứng: 4P + 5O2⟶ 2P2O5
Quá trình oxi hóa là
A. 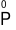 ⟶
⟶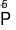 + 5e;
+ 5e;
B.  + 5e ⟶
+ 5e ⟶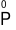 ;
;
C. 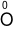 + 2e ⟶
+ 2e ⟶ ;
;
D.  ⟶
⟶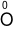 + 2e.
+ 2e.
Hệ số cân bằng của H2 trong phản ứng Fe2O3 + H2⟶ Fe + H2O là
A. 1;
B. 2;
C. 3;
D. 4.
Xác định hệ số cân bằng của HCl trong phản ứng dưới đây:
K2Cr2O7 + HCl ⟶ Cl2 + KCl + CrCl3 + H2O
A. 5;
B. 10;
C. 14;
D. 16.


