18 CÂU HỎI
Phát biểu nào sau đây là đúng khi nói về nguyên tử?
A. Trong nguyên tử, số hạt proton luôn bằng số hạt neutron.
B. Điện tích của một nguyên tử có thể có giá trị âm, dương hoặc bằng 0.
C. Khối lượng của một nguyên tử (tính theo amu) luôn là số nguyên.
D. Lớp vỏ nguyên tử tạo nên bởi các electron.
Hình vẽ nào sau đây mô tả đúng các đường đi của các hạt electron, neutron hoặc proton dưới tác dụng của điện trường trong chân không?
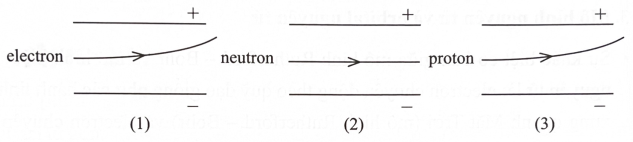
A. Hình 1 và 2.
B. Hình 1 và 3.
C. Hình 2 và 3.
D. Hình 1, 2 và 3.
Nguyên tử \(_{17}^{35}{\rm{Cl}}\) tự do là một trong số các tác nhân gây phá huỷ tầng ozone. Thành phần của nguyên tử này gồm:
A. 17 proton, 18 neutron, 18 electron.
B. 17 proton, 18 neutron, 17 electron.
C. 18 proton, 17 neutron, 17 electron.
D. 18 proton, 19 neutron, 18 electron.
\(_{27}^{60}{\rm{Co}}\) được sử dụng nhiều trong điều trị ung thư. Phát biểu nào sau đây là đúng khi nói về nguyên tử \(_{27}^{60}{\rm{Co}}\)?
A. Nguyên tử có 27 hạt neutron.
B. Hạt nhân nguyên tử có điện tích là 27 Coulomb.
C. Số hạt neutron của nguyên tử Co này khác với số hạt neutron của các nguyên tử đồng vị khác của Co.
D. Nguyên tử có 33 electron.
Nguyên tử hoặc ion nào sau đây có chứa số lượng proton, neutron và electron khác nhau?
A. \(_9^{19}\;{{\rm{F}}^ - }.\)
B. \(_{11}^{23}{\rm{N}}{{\rm{a}}^ + }.\)
C. \(_{15}^{31}{\rm{P}}.\)
D. \(_{16}^{32}\;{\rm{S}}.\)
Ion nào sau đây có số electron nhiều hơn số proton và số proton nhiều hơn số neutron? Biết \({\rm{H}} = _1^1{\rm{H}},{\rm{D}} = _1^2{\rm{H}},{\rm{O}} = _8^{16}{\rm{O}}.\)
A. \({{\rm{D}}^ - }.\)
B. \({{\rm{H}}_3}{{\rm{O}}^ + }.\)
C. \({\rm{O}}{{\rm{D}}^ - }\)
D. \({\rm{O}}{{\rm{H}}^ - }.\)
Số khối của một nguyên tử X gấp hai lần số hiệu nguyên tử của nó. X có 4 electron ở phân lớp 2p. Số neutron của X bằng với số neutron của nguyên tử nào sau đây?
A. \(_{20}^{40}{\rm{Ca}}.\)
B. \(_7^{14}\;{\rm{N}}.\)
C. \(_7^{15}\;{\rm{N}}.\)
D. \(_8^{17}{\rm{O}}.\)
Orbital nào sau đây có dạng hình cầu?
A. s.
B. px
C. py
D. d.
Phát biểu nào sau đây về orbital nguyên tử là không đúng?
A. Mỗi orbital nguyên tử có thể chứa tối đa hai electron.
B. Orbital 1s, 2s và 3s đều có dạng hình cầu.
C. Có thể có các orbital khác ngoài orbital s, p.
D. Các lớp electron khác nhau có cùng một số lượng orbital.
Hình vẽ dưới đây mô tả 3 dạng orbital.
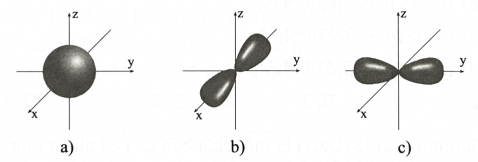
Các orbital tương ứng với các hình a), b) và c) là
A. s, px, py.
B. s, py, pz.
C. s, px, pz.
D. px, py, pz.
Số lượng electron tối đa có thể chứa trong lớp electron thứ 3 là bao nhiêu?
A. 2.
B. 6.
C. 10.
D. 18.
Có bao nhiêu electron thuộc phân lớp p trong cấu hình electron của nguyên tử Al (Z=13)?
A. 1.
B. 2.
C. 6.
D. 7.
Một nguyên tử có 8 electron trong lớp vỏ. Sơ đồ nào sau đây biểu diễn cấu hình electron theo ô orbital của nguyên tử đó?
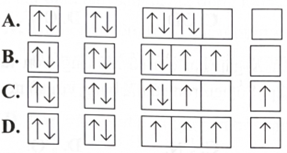
A. Hình A
B. Hình B
C. Hình C
D. Hình D
Số lượng electron độc thân của nguyên tử S (Z=16) là
A. 0.
B. 1.
C. 2.
D. 6.
Khi mất đi 1 electron, nguyên tử hoặc ion nào sau đây sẽ có cấu hình electron mà phân lớp ngoài cùng có số electron bằng một nửa số electron tối đa của phân lớp. Cho biết ZC = 6, ZN = 7, ZO = 8.
A. C-.
B. N.
C. N-.
D. O+.
Trong các cấu hình electron của các nguyên tử sau đây, có bao nhiêu nguyên tử kim loại?
(a) \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}4{s^1}.\)
(b) \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^{10}}4{s^1}.\)
(c) \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^{10}}4{s^2}4{p^5}.\)
(d) \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^{10}}4{s^2}4{p^6}.\)
A. 1.
B. 2.
C. 3.
D. 4.
Gallium nitride (GaN) là một chất bán dẫn có nhiều ứng dụng trong các lĩnh vực công nghệ và điện tử. GaN là một hợp chất ion chứa ion Ga3+. Cấu hình electron nào sau đây biểu diễn cấu hình electron của nitrogen trong gallium nitride? Cho biết ZN = 7.
A. \(1{s^2}2{s^2}.\)
B. \(1{s^2}2{s^2}2{p^3}.\)
C. \(1{s^2}2{s^2}2{p^4}.\)
D. \(1{s^2}2{s^2}2{p^6}.\)
Một cation M+ và một anion X- có cùng cấu hình electron là \(1\;{{\rm{s}}^2}2\;{{\rm{s}}^2}2{{\rm{p}}^6}\)
Phát biểu nào sau đây là đúng?
A. M và X là hai đồng vị của cùng một nguyên tố.
B. M là một kim loại và X là một phi kim.
C. M là một phi kim và X là một kim loại.
D. Số lượng proton của M và X hơn kém nhau 1 đơn vị.

