20 CÂU HỎI
Silic đioxit (SiO2) tan được trong dung dịch của chất nào sau đây?
A. HF.
B. HNO3 đặc.
C. H2SO4 đặc.
D. H3PO4.
Một loại nước thải công nghiệp có pH = 9. Nước thải đó có môi trường
A. bazơ.
B. lưỡng tính.
C.axit.
D. trung tính.
Hoà tan hoàn toàn m gam Al vào dung dịch HNO3 loãng, thu được dung dịch Y chứa 8m gam muối và x mol một chất khí duy nhất là N2O. Cho dung dịch NaOH dư vào Y, kết thúc thí nghiệm có 64,6 gam NaOH đã phản ứng. Giá trị của x gần nhất với
A. 0,148.
B. 0,136.
C. 0,122.
D. 0,082.
Khí X không màu, không mùi, rất độc nhưng được dùng trong luyện kim để khử các oxit kim loại. Khí X là
A. CO.
B. H2.
C. CO2.
D. NH3.
Nhỏ từ từ dung dịch HNO3 đến dư vào dung dịch NH4HCO3, hiện tượng xảy ra là
A. xuất hiện kết tủa trắng.
B. thoát ra khí không màu.
C. thoát ra khí mùi khai.
D. có kết tủa và sủi bọt khí.
Khi thực hiện phản ứng giữa dung dịch HNO3 đặc với kim loại sinh ra khí NO2 độc hại. Để hạn chế khí NO2 thoát ra gây ô nhiễm môi trường, ta phải đậy ống nghiệm bằng bông tẩm
A.nước cất.
B. nước vôi.
C.giấm ăn.
D. cồn y tế.
Thực hiện thí nghiệm với hai mẫu photpho X và Y như hình vẽ:
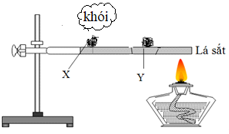
Mẫu X là
A. photpho trắng.
B. photpho đỏ.
C. photpho đen.
D. photpho tím.
Phân urê cung cấp cho cây trồng nguyên tố dinh dưỡng gì?
A. Nitơ.
B. Photpho.
C. Kali.
D. Canxi.
Ngày nay, amoniac lỏng được dùng làm chất sinh hàn trong thiết bị lạnh. Amoniac có công thức hóa học là
A. NH2.
B. N2H4.
C. NH4.
D. NH3.
Chất nào sau đây là chất điện li yếu?
A. H3PO4.
B. HNO3.
C. KOH.
D. Na2CO3.
Trong công nghiệp, axit nitric được tổng hợp từ amoniac qua ba giai đoạn với hiệu suất của toàn bộ quá trình đạt 96%. Theo quá trình trên, từ 2 tấn amoniac người ta thu được m tấn dung dịch HNO3 60%. Giá trị của m là
A. 7,41
B. 11,86.
C. 12,35
D. 12,87
Dung dịch HNO3 0,0001M có pH bằng
A. 11
B. 3
C. 10
D. 4
Dung dịch X gồm 0,05 mol K+, 0,04 mol , 0,03 mol Cl- và . Cô cạn dung dịch X, thu được m gam chất rắn khan. Giá trị của m là:
A. 5,53.
B. 6,07.
C. 5,77.
D. 5,51.
Phản ứng Ba(OH)2 + 2HCl → BaCl2 + 2H2O có phương trình ion thu gọn là:
A.H+ + OH- →H2O.
B. Ba2+ + 2Cl-→BaCl2.
C.2H+ + OH- → 2H2O.
D. Ba2+ + Cl- → BaCl2.
Dẫn từ từ CO2 vào dung dịch chỉ chứa 0,025 mol Ba(OH)2. Đồ thị dưới đây biểu diễn sự phụ thuộc của số mol kết tủa BaCO3 tạo thành theo số mol CO2.
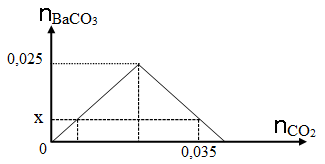 Giá trị của x là
Giá trị của x là
A. 0,035
B. 0,015
C. 0,025
D. 0,010
Số liên kết xích-ma (Ϭ) trong phân tử C4H10 là:
A.10
B. 13
C. 12
D. 14
Hợp chất X có công thức đơn giản nhất là CH2O. Tỉ khối hơi của X so với hiđro bằng 30. Công thức phân tử của X là
A. CH2O
B. C2H4O2
C. C3H6O2
D. C4H8O2.
Hợp chất hữu cơ X (C, H, O và N) có công thức trùng với công thức đơn giản nhất, đốt cháy hoàn toàn 7,5 gam X, thu được 4,48 lít CO2; 1,12 lít N2 (các khí đều đo (đktc)) và 4,5 gam H2O. Số nguyên tử hiđro trong một phân tử X là
A. 7
B. 6
C. 5
D. 9
Số công thức cấu tạo có thể có ứng với các công thức phân tử C3H8O là
A. 1
B. 2
C. 3
D. 4
Trong phòng thí nghiệm người ta điều chế HNO3 từ
A. NH3 và O2.
B. NaNO2 và H2SO4 đặc.
C. NaNO3 và H2SO4 đặc.
D. NaNO2 và HCl đặc.


