28 CÂU HỎI
Phát biểu nào sau đây không đúng?
A. Trong một phân tử, tổng số oxi hoá của các nguyên tử bằng 0.
B. Trong hợp chất, oxygen có số oxi hóa bằng -2, trừ một số trường hợp ngoại lệ.
C. Số oxi hóa của hydrogen trong các hydride kim loại bằng +1.
D. Các nguyên tố phi kim có số oxi hóa thay đổi tùy thuộc vào hợp chất chứa chúng.
Số oxi hoá của chlorine trong hợp chất HClO là
A. +1.
B. -1.
C. +3.
D. +2.
Số oxi hoá của sulfur trong hợp chất là
A. +2.
B. +4.
C. +6.
D. -2.
Chất nào sau đây có tính khử mạnh?
A. KMnO4.
B. F2.
C. H2S.
D. CrO3.
Cho các hợp chất sau: NH3; NH4Cl; NaNO3; HNO3; N2O5. Số hợp chất trong đó nitrogen có số oxi hoá -3 là
A. 1.
B. 2.
C. 3.
D. 4.
Cho các phản ứng hóa học sau:
(a)
(b)
(c)
(d)
Số phản ứng oxi hóa – khử là
A. 4.
B. 2.
C. 3.
D. 1.
Phản ứng oxi hóa – khử là phản ứng có sự chuyển dịch
A. electron giữa các chất.
B. neutron giữa các chất.
C. proton của nguyên tử.
D. cation.
Cho phản ứng: SO2 + Br2 + 2H2O → 2HBr + H2SO4. Trong phản ứng trên, vai trò của SO2 là
A. chất khử.
B. chất oxi hóa.
C. vừa là chất oxi hóa, vừa là chất tạo môi trường.
D. vừa là chất khử, vừa là chất tạo môi trường.
Trong phản ứng nào sau đây HCl đóng vai trò là chất oxi hoá?
A. 8HCl + Fe3O4 → FeCl2 + 2FeCl3 + 4H2O.
B. 2HCl + Na2CO3 → 2NaCl + CO2 + H2O.
C. 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
D. 2HCl + Fe → FeCl2 + H2.
Cho 4,2 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HNO3, thể tích khí NO (đkc) bay ra là (coi NO là sản phẩm khử duy nhất)
A. 1,8593 lít.
B. 3,3600 lít.
C. 3,7185 lít.
D. 5,6360 lít.
Cho phản ứng hoá học sau: Al + HNO3 → Al(NO3)3 + NO + H2O. Hệ số cân bằng (là số nguyên, tối giản) của các chất trong sản phẩm lần lượt là
A. 1, 1, 2.
B. 8, 3, 9.
C. 2, 2, 5.
D. 2, 1, 4.
Trong phản ứng: Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O. Số phân tử nitric acid (HNO3) đóng vai trò chất oxi hóa là
A. 8.
B. 6.
C. 4.
D. 2.
Trên thế giới, zinc (kẽm) được sản xuất chủ yếu từ quặng zinc blende có thành phần chính là ZnS. Ở giai đoạn đầu của quá trình sản xuất, quặng zinc blende được nung trong không khí để thực hiện phản ứng:
ZnS + O2 ZnO + SO2
Tổng hệ số cân bằng (là các số nguyên, tối giản) của chất tham gia trong phản ứng là
A. 4.
B. 5.
C. 6.
D. 7
Dẫn khí SO2 vào 10 mL dung dịch KMnO4 0,02M đến khi dung dịch vừa mất màu tím. Phản ứng xảy ra theo sơ đồ sau:
SO2 + KMnO4 + H2O H2SO4 + K2SO4 + MnSO4
Thể tích khí SO2 đã tham gia phản ứng ở điều kiện chuẩn là
A. 12,395 lít.
B. 12,395 mL.
C. 123,95 mL.
D. 123,95 lít.
Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất, kí hiệu là
A.
B.
C.
D.
Phát biểu nào sau đây không đúng?
A. Các phản ứng cháy thường là phản ứng tỏa nhiệt.
B. Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra.
C. Các phản ứng phân hủy thường là phản ứng thu nhiệt.
D. Các phản ứng khi đun nóng đều dễ xảy ra hơn.
Cho phản ứng sau:
C(s) + O2(g) → CO2(g)
Nhiệt tạo thành chuẩn của CO2(g) là
A. 393,5 kJ/ mol.
B. – 393,5 kJ/ mol.
C. 39,35 kJ/ mol.
D. – 39,35 kJ/ mol.
Cho các phản ứng sau:
(1) H2(g) + Cl2(g) ® 2HCl (g)
(2) CH4(g) + H2O(l) → CO(g) + 3H2(g)
Phát biểu đúng là
A. Cả hai phản ứng đều toả nhiệt.
B. Cả hai phản ứng đều thu nhiệt.
C. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt
D. Phản ứng (2) thu nhiệt, phản ứng (1) toả nhiệt.
Cho các phát biểu sau:
(a). Trong phòng thí nghiệm, có thể nhận biết một phản ứng thu nhiệt hoặc toả nhiệt bằng cách đo nhiệt độ của phản ứng bằng một nhiệt kế.
(b). Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng thu nhiệt.
(c). Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng toả nhiệt.
(d). Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng toả nhiệt.
(e). Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng thu nhiệt.
Số phát biểu không đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Biết rằng ở điều kiện chuẩn, 1 mol ethanol cháy tỏa ra một nhiệt lượng là 1,37 × 103 kJ. Nếu đốt cháy hoàn toàn 15,1 gam ethanol, năng được được giải phóng ra dưới dạng nhiệt bởi phản ứng là
A. 0,450 kJ.
B. 2,25 × 103 kJ.
C. 4,50 × 102 kJ.
D. 1,37 × 103 kJ.
ethanol, năng được được giải phóng ra dưới dạng nhiệt bởi phản ứng là
A. 0,450 kJ.
B. 2,25 × 103 kJ.
C. 4,50 × 102 kJ.
D. 1,37 × 103 kJ.
Phương trình nhiệt học của phản ứng nhiệt phân hoàn toàn 1 mol Cu(OH)2 ở điều kiện chuẩn, tạo thành 1 mol CuO và 1 mol H2O, thu vào nhiệt lượng 9,0 kJ là
A. Cu(OH)2(s) CuO(s) + H2O(l); = –9,0 kJ.
B. Cu(OH)2(s) CuO(s) + H2O(l); = +9,0 kJ.
C. CuO(s) + H2O(l) Cu(OH)2(s); = –9,0 kJ.
D. CuO(s) + H2O(l) Cu(OH)2(s); = +9,0 kJ.
Cho phản ứng sau:
SO2(g) + O2(g) ® SO3(l)
Biến thiên enthalpy chuẩn của phản ứng tính theo nhiệt tạo thành là
A.
B.
C.
D.
Xác định biến thiên enthalpy chuẩn của phản ứng:
C2H2(g) + 2H2(g) ® C2H6(g)
Biết năng lượng liên kết (ở điều kiện chuẩn): Eb (H–H) = 436 kJ/mol; Eb (C–H) = 418 kJ/mol; Eb (CºC) = 837 kJ/mol.
A. +309 kJ.
B. –309 kJ.
C. –358 kJ.
D. +358 kJ.
Phát biểu nào sau đây không đúng?
A. Để so sánh biến thiên enthalpy của các phản ứng khác nhau thì cần xác định chúng ở cùng một điều kiện.
B. Phản ứng hóa học là quá trình phá vỡ các liên kết trong chất đầu và hình thành các liên kết mới để tạo thành sản phẩm.
C. Sự phá vỡ liên kết giải phóng năng lượng, trong khi sự hình thành liên kết lại cần cung cấp năng lượng.
D. Khi than, củi cháy, không khí xung quanh ấm hơn do phản ứng tỏa nhiệt.
Cho các phản ứng sau:
(1) Phản ứng tôi vôi: CaO + H2O → Ca(OH)2.
(2) Phản ứng trung hoà acid – base: HCl + NaOH → NaCl + H2O.
(3) Phản ứng nhiệt phân potassium chlorate: 2KClO3 2KCl + 3O2.
Phản ứng toả nhiệt là
A. (1).
B. (2).
C. (3).
D. (1), (2).
Cho phản ứng sau:
CO(g) + O2(g) ® CO2(g)
Biến thiên enthalpy của phản ứng ở điều kiện chuẩn là
(Biết nhiệt tạo thành chuẩn của CO2(g) là –393,5 kJ/mol, của CO(g) là –110,5 kJ/mol).
A. –283 kJ.
B. +283 kJ.
C. –316 kJ.
D. +316 kJ
Khẳng định sai là
A.Nếu biến thiên enthalpy có giá trị âm thì phản ứng tỏa nhiệt.
B.Nếu biến thiên enthalpy có giá trị dương thì phản ứng thu nhiệt.
C.Biến thiên enthalpy càng âm thì phản ứng tỏa nhiệt càng ít.
D.Biến thiên enthalpy càng dương thì phản ứng thu nhiệt càng nhiều.
Biến thiên enthalpy chuẩn của một phản ứng được mô tả ở sơ đồ dưới đây:
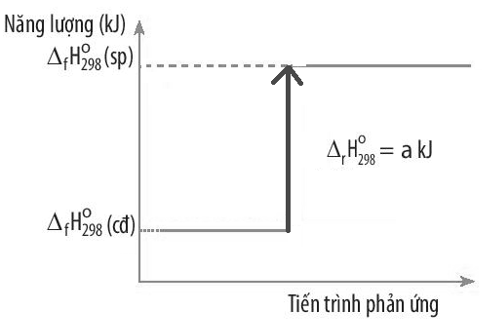
Kết luận nào sau đây đúng?
A. Phản ứng tỏa nhiệt.
B. Năng lượng chất tham gia phản ứng lớn hơn năng lượng sản phẩm.
C. Biến thiên enthalpy của phản ứng là -a kJ/mol.
D. Phản ứng thu nhiệt.

