28 CÂU HỎI
Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. electron và neutron.
B. proton và neutron.
C. neutron và electron.
D. electron, proton và neutron.
Nếu đường kính của nguyên tử khoảng 102 pm thì đường kính của hạt nhân khoảng
A. 102 pm.
B. 10-4 pm.
C. 10-2 pm.
D. 104 pm.
Số neutron (N) trong nguyên tử của một nguyên tố hoá học có thể tính được khi biết số khối (A), số hiệu nguyên tử (Z) theo công thức:
A. A = Z – N.
B. N = A – Z.
C. A = N – Z.
D. Z = N + A.
Nguyên tử Z có 7 neutron và 6 proton. Kí hiệu nguyên tử của Z là
A.
B.
C.
D.
Hình ảnh dưới đây là hình dạng của loại orbital nguyên tử nào?
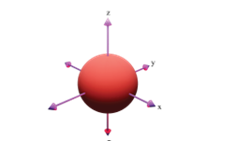
A. Orbital s.
B. Orbital p.
C. Orbital d.
D. Orbital f.
Lớp M có bao nhiêu phân lớp?
A. 1
B. 2
C. 3
D. 4
Cho nguyên tử X có 2 lớp eletron, lớp thứ 2 có 6 electron. Số hiệu nguyên tử X là
A. 1
B. 2
C. 12
D. 16
Ở trạng thái cơ bản, nguyên tử phosphorus (P) có số electron độc thân là
A. 1
B. 2
C. 3
D. 4
Nhóm nguyên tố là
A. tập hợp các nguyên tố mà nguyên tử có cùng cấu hình electron giống nhau được xếp ở cùng một cột.
B. tập hợp các nguyên tố mà nguyên tử có cấu hình electron gần giống nhau, do đó có tính chất hóa học giống nhau và được xếp thành một cột.
C. tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp cùng một cột.
D. tập hợp các nguyên tố mà nguyên tử có tính chất hóa học giống nhau và được xếp cùng một cột.
Nguyên tố nào sau đây thuộc nhóm A?
A. [Ne]3s23p3.
B. [Ar]3d14s2.
C. [Ar]3d74s2.
D. [Ar]3d54s2.
Trong các nguyên tố nhóm A, đại lượng nào sau đây không biến đổi tuần hoàn?
A. Bán kính nguyên tử.
B. Tính kim loại.
C. Độ âm điện.
D. Khối lượng nguyên tử.
Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, những yếu tố sẽ tăng dần là
A. bán kính nguyên tử và tính phi kim.
B. độ âm điện và tính phi kim.
C. bán kính nguyên tử và tính kim loại.
D. độ âm điện và tính kim loại.
Nguyên tố R có cấu hình electron: 1s22s22p4. Công thức hợp chất oxide ứng với hóa trị cao nhất của R là
A. RO3.
B. R2O3.
C. R2O7.
D. R2O5.
Dãy nào sau đây sắp xếp thứ tự tăng dần tính acid?
A. H3PO4 ; H2SO4 ; H3AsO4.
B. H2SO4 ; H3AsO4 ; H3PO4.
C. H3PO4; H3AsO4; H2SO4.
D. H3AsO4; H3PO4; H2SO4 .
Nguyên tố X ở chu kì 2, nhóm IIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
A. 1s²2s²2p2.
B. 1s²2s2.
C. 1s²2s³.
D. 1s²2s²2p63s².
X và Y thuộc cùng một nhóm và ở hai chu kì liên tiếp. Tổng số đơn vị điện tích hạt nhân của X và Y là 18 (biết ZX < ZY). Hai nguyên tố X; Y là
A. Be (Z = 4) và Si (Z = 14).
B. B (Z = 5) và Al (Z = 13).
C. N (Z = 7) và Na (Z = 11).
D. C (Z = 6) và Mg (Z = 12).
Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt tới cấu hình electron bền vững theo quy tắc octet?
A. X (Z = 12).
B. Y (Z = 9).
C. Q (Z = 11).
D. T(Z = 10).
Công thức electron nào sau đây không đủ electron theo quy tắc octet?
A. 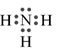
B. 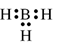
C. 
D. 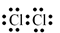
Liên kết ion có bản chất là
A. sự dùng chung các electron.
B. lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
C. lực hút tĩnh điện giữa cation kim loại với các electron tự do.
D. lực hút giữa các phân tử.
Cặp nguyên tố nào sau đây có khả năng tạo thành liên kết ion trong hợp chất của chúng?
A. Nitrogen và oxygen.
B. Carbon và oxygen.
C. Sulfur và oxygen.
D. Calcium và oxygen.
Hợp chất nào sau đây có liên kết cộng hóa trị phân cực?
A. H2.
B. NH3.
C. CH4.
D. N2.
Dãy nào sau đây gồm các chất chỉ có liên kết cộng hóa trị?
A. CaCl2, NaCl, NO2.
B. SO2, CO2, K2O.
C. SO3, H2S, H2O.
D. MgCl2, Na2O, HCl.
Trong phân tử nitrogen (N2), mỗi nguyên tử nitrogen đã góp ba electron để tạo cặp electron chung. Nhờ đó, mỗi nguyên tử nitrogen đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe.
B. Ne.
C. Ar.
D. Kr.
Phát biểu nào sau đây không đúng?
A.Chỉ có các AO có hình dạng giống nhau mới xen phủ với nhau để tạo liên kết.
B.Khi hình thành liên kết cộng hoá trị giữa hai nguyên tử, luôn có một liên kết δ.
C.Liên kết δ bền vững hơn liên kết π.
D.Có hai kiểu xen phủ hình thành liên kết là xen phủ trục và xen phủ bên.
Công thức Lewis của H2O là
A. 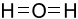
B. 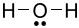
C. 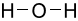
D. 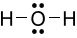
Phát biểu nào sau đây đúng với độ bền của một liên kết?
A. Khi nhiều liên kết được hình thành giữa hai nguyên tử, độ bền của liên kết sẽ giảm.
B. Độ bền của liên kết tăng khi độ dài của liên kết tăng.
C. Độ bền của liên kết tăng khi độ dài của liên kết giảm.
D. Độ bền của liên kết không phụ thuộc vào độ dài liên kết.
Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của
A. các nguyên tử trong phân tử.
B. các electron trong phân tử.
C. các proton trong hạt nhân.
D. các neutron và proton trong hạt nhân.
Mặc dù chlorine có độ âm điện là 3,16 xấp xỉ với nitrogen là 3,04 nhưng giữa các phân tử HCl không tạo được liên kết hydrogen với nhau, trong khi giữa các phân tử NH3 tạo được liên kết hydrogen với nhau, nguyên nhân là do
A. độ âm điện của chlorine nhỏ hơn nitrogen.
B. phân tử NH3 chứa nhiều nguyên tử hydrogen nhỏ hơn phân tử HCl.
C. tổng số nguyên tử trong phân tử NH3 nhiều hơn so với phân tử HCl.
D. kích thước nguyên tử chlorine lớn hơn nguyên tử nitrogen nên mật độ điện tích âm trên chlorine không đủ lớn để hình thành liên kết hydrogen.

