28 CÂU HỎI
Phản ứng thuận nghịch là phản ứng
A. xảy ra theo hai chiều ngược nhau trong cùng điều kiện.
B. có phương trình hoá học được biểu diễn bằng mũi tên một chiều.
C. chỉ xảy ra theo một chiều nhất định.
D. xảy ra giữa hai chất khí.
Mối quan hệ giữa tốc độ phản ứng thuận (vt) và tốc độ phản ứng nghịch (vn) ở trạng thái cân bằng được biểu diễn như thế nào?
A.vt = 2vn.
B. vt = vn.
C. vt = 0,5vn.
D. vt = vn = 0.
Các yếu tố ảnh hưởng đến cân bằng hoá học là
A. nồng độ, nhiệt độ và chất xúc tác.
B. áp suất, nhiệt độ và chất xúc tác.
C. nồng độ, nhiệt độ và áp suất.
D. nồng độ, áp suất và diện tích bề mặt.
Khi một hệ ở trạng thái cân bằng thì trạng thái đó là
A. cân bằng tĩnh.
B. cân bằng động.
C. cân bằng bền.
D. cân bằng không bền.
Xét phản ứng thuận nghịch tổng quát: aA + bB cC + dD. Ở trạng thái cân bằng, hằng số cân bằng (KC) của phản ứng được xác định theo biểu thức:
A.
B.
C.
D.
Biểu thức nào sau đây là biểu thức hằng số cân bằng (KC) của phản ứng:
C(s) + 2H2(g) CH4(g)
A. .
B. .
C. .
D. .
Cho cân bằng hóa học sau: N2(g) + 3H2(g) 2NH3(g) có ∆H < 0. Cân bằng trên chuyển dịch theo chiều thuận khi
A. tăng nhiệt độ của hệ phản ứng.
B. giảm áp suất của hệ phản ứng.
C. tăng áp suất của hệ phản ứng.
D. thêm chất xúc tác vào hệ phản ứng.
Cho cân bằng hóa học sau: CaCO3(s) CaO(s) + CO2(g)
Yếu tố nào sau đây làm cho cân bằng dịch chuyển theo chiều thuận?
A. Tăng nồng độ khí CO2.
B. Tăng áp suất.
C. Giảm nhiệt độ.
D. Tăng nhiệt độ.
Đối với phản ứng sau, cân bằng sẽ bị ảnh hưởng như thế nào khi tăng nhiệt độ (các điều kiện khác giữ không đổi)?
H2(g) + O2(g) H2O(l) = -286 kJ
A. Cân bằng chuyển dịch sang phải.
B. Cân bằng chuyển dịch sang trái.
C. Không thay đổi.
D. Không dự đoán được sự chuyển dịch cân bằng.
Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của chúng có các
A. ion trái dấu.
B. anion (ion âm).
C. cation (ion dương).
D. chất.
Chất nào sau đây không phải chất điện li?
A. KOH.
B. HCl.
C. HNO3.
D. C2H5OH.
Trường hợp nào sau đây dẫn điện được?
A. KCl rắn, khan.
B. Glucose tan trong nước.
C. CaCl2 rắn, khan.
D. HCl hòa tan trong nước.
Phương trình điện li viết đúng là
A.
B. KOH → K+ + OH-.
C.
D.
Dung dịch nào sau đây có pH >7?
A. NaOH.
B. CH3COOH.
C. HNO3.
D. HCl.
Dãy gồm các chất điện li mạnh là
A. KOH, NaCl, H2S.
B. Na2S, H2S , HCl.
C. CH3COOH, NaNO3, Ca(OH)2.
D. HCl, NaNO3, Ba(OH)2.
Dung dịch acid HCl có nồng độ 0,001M có pH bằng bao nhiêu?
A. 1,0.
B. 3,0.
C. 11,0.
D. 12,0.
Cho các chất:NH3, HCl, H3PO4, Ba(OH)2. Theo thuyết Bronsted – Lowry có bao nhiêu chất trong dãy trên là acid?
A. 3.
B. 4.
C. 5.
D. 2.
Nồng độ mol/L của ion Cl− trong dung dịch CaCl2 0,3 M là
A. 0,15.
B. 0,5.
C. 0,6.
D. 0,3.
Khí nào phổ biến nhất trong khí quyển Trái Đất?
A. Oxygen.
B. Nitrogen.
C. Ozone.
D. Argon.
Vị trí (chu kì, nhóm) của nguyên tố nitrogen trong bảng tuần hoàn là
A. chu kì 2, nhóm VA.
B. chu kì 3, nhóm VA.
C. chu kì 2, nhóm VIA.
D. chu kì 3, nhóm IVA.
Quan sát hình bên dưới và từ dữ kiện năng lượng liên kết trong phân tử N2, dự đoán về độ bền phân tử và khả năng phản ứng của nitrogen ở nhiệt độ thường.
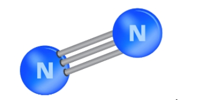
.
Eb (NºN) = 945 kJ/mol
A. Kém bền và hoạt động hóa học mạnh ở nhiệt độ thường.
B. Bền và trơ về mặt hóa học mạnh ở nhiệt độ thường.
C. Bền và hoạt động hóa học mạnh ở nhiệt độ thường.
D. Kém bền và trơ về mặt hóa học mạnh ở nhiệt độ thường.
Trong công thức Lewis của phân tử NH3. Nhận định nào đúng?
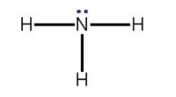
A. Nguyên tử hydrogen còn có một electron không liên kết.
B. Nguyên tử ntrogen còn có một electron không liên kết.
C. Nguyên tử ntrogen còn có một cặp electron không liên kết.
D. Liên kết N-H kém bền.
Để nhận biết ion NH4+ trong dung dịch, thuốc thử cần dùng là
A. dung dịch H2SO4.
B. dung dịch NaOH.
C. dung dịch NaNO3.
D. dung dịch NH3.
Phát biểu nào sau đây không đúng?
A. Trong phân tử NH3 và ion NH4+ nitrogen đềucósố oxi hóa-3.
B. Phân tử NH3có tính base, ion NH4+ có tính acid.
C. Phân tử NH3và ion NH4+ đều có liên kết cộng hóa trị.
D. Phân tử NH3 có tính acid yếu và ion NH4+ có tính base.
Trong các PTHH sau, phản ứng nào NH3 không đóng vai trò là chất khử?
A. NH3 + HCl®NH4Cl
B. 2NH3 + 3Cl2 → N2 + 6HCl.
C. 4NH3 + 5O2 → 4NO + 6H2O.
D. 2NH3 + 3CuO → N2 + 3Cu+ 3H2O.
Bóng cười được bơm một loại khí có tên gọi là Dinitrogen. Công thức phân tử của Dinitrogen là
A. NO.
B. N2O4.
C. NO2.
D. N2O.
Cho các nhận định sau về cấu tạo phân tử nitric acid:
(a) Liên kết O-H phân cực về oxygen.
(b) Nguyên tử có số oxi hoá là +5.
(c) Liên kết cho - nhận kém bền.
Số nhận định đứng là
A. 1.
B. 2.
C. 3.
D. 4.
X là một trong các nguyên nhân gây ra mưa acid, sương mù quang hoá, hiệu ứng nhà kính, hiện tượng phù nhưỡng, ô nhiễm môi trường .… X là
A. NH3.
B. SO2.
C. NOx.
D. HNO3.

